1.脂質(zhì)體概述
1965年,英G學者Bangham和Standish將磷脂分散在水中進行電鏡觀察時發(fā)現(xiàn)了脂質(zhì)體。磷脂分散在水中自然形成多層囊泡,每層均為脂質(zhì)的雙分子層;囊泡中央和各層之間被水相隔開,雙分子層厚度約為4納米。后來,將這種具有類似生物膜結(jié)構(gòu)的雙分子小囊稱為脂質(zhì)體。此兩位學者曾獲得過諾貝爾獎提名。
某些磷脂分散在過量的水中形成了脂質(zhì)體,該脂分子本身排成雙分子層,在磷脂的主要相變溫度(Tm)以上,瞬間形成泡囊,且泡囊包圍水液,根據(jù)磷脂種類及制備時所用溫度,雙分子層可以是凝膠或液晶狀態(tài)。在凝膠態(tài)時磷脂烴鏈是一種有規(guī)律的結(jié)構(gòu),在液態(tài)時烴鏈是無規(guī)律的
,每一種用來制備脂質(zhì)體的純磷脂由凝膠狀態(tài)過渡到液晶狀態(tài)時均具有特征的相變溫度。這種相變溫度(Tin)是根據(jù)磷脂性質(zhì)而變(見下表),它可在-20~+90℃之間變化,雙分子層的不同成分混合物可引起相變溫度的變化或相變完全消失,當雙分子層通過相變溫度時,被封閉的水溶性標示物的漏出量增加。
|
磷脂種類 |
相變溫度(℃) |
|
卵磷脂(卵磷脂膽堿) |
-15—7 |
|
腦磷脂酰絲氨酸 |
6—8 |
|
二棕櫚磷脂 |
41 |
|
氫化大豆磷脂 |
51 |
脂質(zhì)體的相變行為決定了脂質(zhì)體的通透性、融合、聚集及蛋白結(jié)合能力,所有這些都明顯影響脂質(zhì)體的穩(wěn)定性和它們在生物體系中的行為。
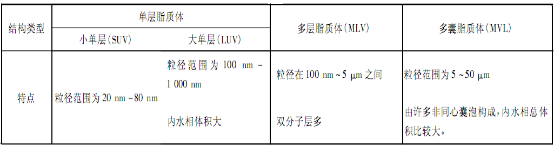
脂質(zhì)體根據(jù)其脂質(zhì)膜的層數(shù)和腔室的數(shù)量,可以分為單層脂質(zhì)體,多層脂質(zhì)體和多囊脂質(zhì)體,單層脂質(zhì)體。不同類型的脂質(zhì)體其結(jié)構(gòu)特點各不相同,見下圖表。
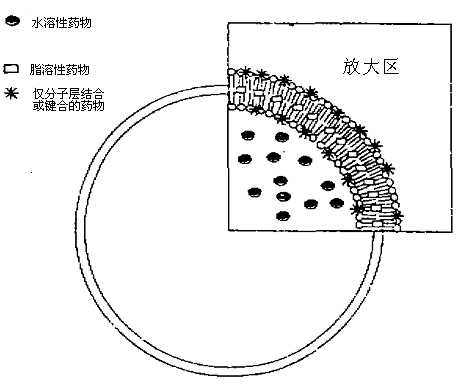
1971年,英GRymen等人開始將脂質(zhì)體用作藥物載體。所謂載體,可以是一組分子,包蔽于藥物外,通過滲透或被巨嗜細胞吞噬后載體被酶類分解而釋放藥物,從而發(fā)揮作用。它具有類細胞結(jié)構(gòu),進入動物體內(nèi)主要被網(wǎng)狀內(nèi)皮系統(tǒng)吞噬而激活機體的自身免疫功能,并改變被包封藥物的體內(nèi)分布,使藥物主要在肝、脾、肺和骨髓等組織器官中積蓄,從而提高藥物的治療指數(shù),減少藥物的治療劑量和降低藥物的毒性。脂質(zhì)體技術是被喻為“生物導彈”的第四代靶向給藥技術,也是目前G際上**熱門的制藥技術。**于藥物在脂質(zhì)體中的負載定位,其取決于所載藥物的性質(zhì),見下圖。
 2.脂質(zhì)體制備方法分類及其介紹
2.脂質(zhì)體制備方法分類及其介紹
脂質(zhì)體是由磷脂分子在水相中通過疏水作用形成的,因此制備脂質(zhì)體所強調(diào)的不是膜組裝,而是如何形成適當大小、包封率高和穩(wěn)定性高的囊泡。制備的方法不同,脂質(zhì)體的粒徑可從幾十納米到幾微米,并且結(jié)構(gòu)也不盡相同。
目前,制備脂質(zhì)體的方法較多,常用的有薄膜法、反相蒸發(fā)法、溶劑注入法和復乳法等,這些方法一般稱為被動載藥法,而pH梯度法,硫酸銨梯度法一般被稱為主動載藥法。
2.1被動載藥法
脂質(zhì)體常用制備方法主要有薄膜分散法、反相蒸發(fā)法、注入法、超聲波分散等。在制備含藥脂質(zhì)體時,shou先將藥物溶于水相或有機相中,然后按適宜的方法制備含藥脂質(zhì)體,該法適于脂溶性強的藥物,所得脂質(zhì)體具有較高包封率。
2.1.1 薄膜分散法
此法**初由Bangham 等報道,是**原始但又是迄今為止**基本和應用**廣泛的脂質(zhì)體的制備方法。將磷脂和膽固醇等類脂及脂溶性藥物溶于有機溶劑,然后將此溶液置于一大的圓底燒瓶中,再旋轉(zhuǎn)減壓蒸干,磷脂在燒瓶內(nèi)壁上會形成一層很薄的膜,然后加入一定量的緩沖溶液,充分振蕩燒瓶使脂質(zhì)膜水化脫落,即可得到脂質(zhì)體。這種方法對水溶性藥物可獲得較高的包封率,但是脂質(zhì)體粒徑在0.2~5 μm 之間,可通過超聲波儀處理或者通過擠壓使脂質(zhì)體通過固定粒徑的聚碳酸酯膜,在一定程度上降低脂質(zhì)體的粒徑。
2.1.2 超聲分散法
將磷脂、膽固醇和待包封藥物一起溶解于有機溶劑中,混合均勻后旋轉(zhuǎn)蒸發(fā)去除有機溶劑,將剩下的溶液再經(jīng)超聲波處理,分離即得脂質(zhì)體。超聲波法可分為兩種“水浴超聲波法和探針超聲波法”,本法是制備小脂質(zhì)體的常用方法,但是超聲波易引起藥物的降解問題。
2.1.3 冷凍干燥法
脂質(zhì)體混懸液在貯存期間易發(fā)生聚集、融合及藥物滲漏,且磷脂易氧化、水解,難以滿足藥物制劑穩(wěn)定性的要求。1978 年Vanleberghe 等**報道采用冷凍干燥法提高脂質(zhì)體的貯存穩(wěn)定性。目前,該法已成為較有前途的改善脂質(zhì)體制劑長期穩(wěn)定性的方法之一。
脂質(zhì)體冷凍干燥包括預凍、初步干燥及二次干燥 3 個過程。凍干脂質(zhì)體可直接作為固體劑型,如噴霧劑使用,也可用水或其它溶劑化重建成脂質(zhì)體混懸液使用,但預凍、干燥和復水等過程均不利于脂質(zhì)體結(jié)構(gòu)和功能的穩(wěn)定。如在凍干前加入適宜的凍干保護劑,采用適當?shù)墓に嚕瑒t可大大減輕甚**消除凍干過程對脂質(zhì)體的破壞,復水后脂質(zhì)體的形態(tài)、粒徑及包封率等均無顯著變化。單糖、二糖、寡聚糖、多糖、多元醇及其他水溶性高分子物質(zhì)都可以用做脂質(zhì)體凍干保護劑,其中二糖是研究**多也是**有效的,常用的有海藻糖、麥芽糖、蔗糖及乳糖。本法適于熱敏型藥物前體脂質(zhì)體的制備,但成本較高。陳建明等以大豆磷脂為膜材,以甘露醇為凍干保護劑,采用凍干法制備了維生素A前體脂質(zhì)體,復水化后平均粒徑為0.6151μm ,包封率 98.5%。林中方等采用凍干法制備了鬼臼毒素體脂質(zhì)體,復水化后平均粒徑為 1.451μm ,包封率 72.3%,但是這種方法仍然存在著不足之處,例如脂質(zhì)體復水化后粒徑分布不夠均勻。#p#分頁標題#e#
2.1.4 凍融法
此法shou先制備包封有藥物的脂質(zhì)體,然后冷凍。在快速冷凍過程中,由于冰晶的形成,使形成的脂質(zhì)體膜破裂,冰晶的片層與破碎的膜同時存在,此狀態(tài)不穩(wěn)定,在緩慢融化過程中,暴露出的脂膜互相融合重新形成脂質(zhì)體。何文等分別用反相蒸發(fā)法、乳化法和凍融法制備了甲氧沙林脂質(zhì)體。通過研究發(fā)現(xiàn),凍融法制備的脂質(zhì)體的包封率**高,但是粒徑**大。反復凍融可以提高脂質(zhì)體的包封率,**健松制備了阿奇霉素脂質(zhì)體,實驗發(fā)現(xiàn),經(jīng)3次重復凍融后,阿奇霉素脂質(zhì)體的包封率從61.4% 增加到78%,但是當凍融次數(shù)增加到4次,包封率變化很小。該制備方法適于較大量的生產(chǎn),尤其對不穩(wěn)定的藥物**適合。
2.1.5 復乳法
此法第1步將磷脂溶于有機溶劑,加入待包封藥物的溶液,乳化得到W/O 初乳,第2步將初乳加入到10倍體積的水中混合,乳化得到W/O/W乳液,然后在一定溫度下去除有機溶劑即可得到脂質(zhì)體。Kim用乳化法制得脂質(zhì)體的包封率比較高,但是粒徑較大。Tomoko等通過研究發(fā)現(xiàn),第2步乳化過程和有機溶劑的去除過程的溫度對脂質(zhì)體的粒徑有比較大的影響,較低的溫度有利于減小脂質(zhì)體的粒徑,通過控制溫度可以制得粒徑為400 nm,包封率達到 90%的脂質(zhì)體。
2.1.6 注入法
將類脂質(zhì)和脂溶性藥物溶于有機溶劑中(油相),然后把油相均速注射到水相(含水溶性藥物)中,攪拌揮盡有機溶劑,再乳勻或超聲得到脂質(zhì)體。根據(jù)溶劑的不同可分為乙醇注入法和乙醚注入法。
乙醇注入法避免了使用有機溶劑,丁麗燕用乙醇法制備了司帕沙星脂質(zhì)體,通過研究發(fā)現(xiàn)慢速注入可制得具有較高包封率的脂質(zhì)體,其包封率為47%。
乙醚注入法制備的脂質(zhì)體大多為單室脂質(zhì)體,粒徑jue大多數(shù)在2 μm以下,操作過程中溫度比較低(40℃),因此,該方法適用于在乙醚中有較好溶解度和對熱不穩(wěn)定藥物,同時通過調(diào)節(jié)乙醚中不同磷脂的濃度,可以得到不同粒徑且粒徑分布均勻的脂質(zhì)體混懸液。
2.1.7 反相蒸發(fā)法
**初由Szoka提出,一般的制法是將磷脂等膜材溶于有機溶劑中,短時超聲振蕩,直**形成穩(wěn)定的W/O乳液,然后減壓蒸發(fā)除掉有機溶劑,達到膠態(tài)后,滴加緩沖液,旋轉(zhuǎn)蒸發(fā)使器壁上的凝膠脫落,然后在減壓下繼續(xù)蒸發(fā),制得水性混懸液,除去未包入的藥物,即得大單層脂質(zhì)體脂質(zhì)體。此法可包裹較大的水容積,一般適用于包封水溶性藥物、大分子生物活性物質(zhì)等。
2.1.8 超臨界法
傳統(tǒng)的脂質(zhì)體制備方法,必須要使用氯仿
、乙醚、甲醇等有機溶劑,這對環(huán)境和人體都是有害的。超臨界二氧化碳是一種無毒、惰性且對環(huán)境無害的反應介質(zhì)。嚴賓等用超臨界法制備了頭孢唑林鈉脂質(zhì)體,將一定量的卵磷脂溶解于乙醇中配得卵磷酯乙醇溶液,與頭孢唑啉鈉溶液一起放入加入高壓釜中,將高壓釜放入恒溫水浴中,通入CO
2。在其超臨界態(tài)下孵化30min,制備脂質(zhì)體。采用超臨界CO
2法制備的包封率高、粒徑小,穩(wěn)定性增強。
2.2 主動載藥
對于兩親性藥物,如某些弱酸弱堿,其油水分配系數(shù)介質(zhì)pH和離子強度的影響較大,用被動載藥法制得的脂質(zhì)體包封率低。
主動載藥是利用兩親性的藥物,能以電中性的形式跨越脂質(zhì)雙層,但其電離形式卻不能跨越的原理來實現(xiàn)的。通過形成脂質(zhì)體膜內(nèi)、外水相的pH梯度差異,使脂質(zhì)體外水相的藥物自發(fā)地向脂質(zhì)體內(nèi)部聚集。
此法通常用脂質(zhì)體包封酸性緩沖鹽,然后用堿把外水相調(diào)成中性,建立脂質(zhì)體內(nèi)外的pH 梯度。藥物在外水相的pH環(huán)境下以親脂性的中性形式存在,能夠透過脂質(zhì)體雙層膜。而在脂質(zhì)體內(nèi)水相中藥物被質(zhì)子化轉(zhuǎn)為離子形式,不能再通過脂質(zhì)體雙層回到外水相,因而被包封在脂質(zhì)體中。主動載藥法廣義上就是指pH 梯度法。人們把其細分為:(1)pH梯度法;(2)硫酸銨梯度法;(3)醋酸鈣梯度法。其中硫酸銨梯度法和醋酸鈣梯度法只是pH梯度法的兩種特殊形式。
2.2.1 pH梯度法
pH梯度法通過調(diào)節(jié)脂質(zhì)體內(nèi)外水相的pH值,形成一定的pH梯度差,弱酸或弱堿藥物則順著pH梯度,以分子形式跨越磷脂膜而使以離子形式被包封在內(nèi)水相中。
趙妍等用以pH梯度法制備硫酸長春新堿脂質(zhì)體,其包封率大于85%,而被動載藥法制備的硫酸長春新堿脂質(zhì)體的包封率**高為14.4%。Jia等用pH梯度法內(nèi)水相pH 0.5%外水相pH4.0制備了卡苯達唑脂質(zhì)體,包封率高于95%。杜松等用pH梯度法制備鹽酸去氫駱駝蓬堿脂質(zhì)體,包封率大于80%,研究表明,雖然制得的脂質(zhì)體沒有加強藥物的抗癌活性,但是大大降低了其毒副作用。
跨膜pH梯度是影響包封率的**主要因素,通常pH梯度越大,載入脂質(zhì)體內(nèi)的藥物越多,包封率也越高。制備伊立替康脂質(zhì)體時,當pH梯度≥3.7時包封率達97%以上,當pH梯度<2時,包封率不到5%;Mamyer等在研究中發(fā)現(xiàn)通過跨膜pH梯度法制備多柔比星脂質(zhì)體,pH梯度達到3.5時包封率達98%,降低內(nèi)水相緩沖液的pH可增大pH梯度,但會加劇磷脂的水解,降低脂質(zhì)體的穩(wěn)定性。#p#分頁標題#e#
此外,藥物自身性質(zhì)如油水分配系數(shù)、膜滲透性等亦可影響包封率。Quan等用pH梯度法制備多巴胺脂質(zhì)體,由于多巴胺親水性較強,無法直接克服能量壁壘穿過脂質(zhì)雙分子層進入內(nèi)水相,但與拉沙洛西(lasalocid)結(jié)合形成復合物可暴露出親脂性表面,即可穿過脂質(zhì)膜進入脂質(zhì)體,包封率提高到85%。氧化苦參堿水溶性較大,脂溶性較弱,因此采用pH梯度法制備脂質(zhì)體包封率只有50%。
2.2.2 硫酸銨梯度法
硫酸銨梯度法通過游離氨擴散到脂質(zhì)體外,間接形成pH梯度,使藥物積聚到脂質(zhì)體內(nèi)。其方法為先將硫酸銨包與脂質(zhì)體內(nèi)水相,然后通過透析、凝膠色譜或超濾的方法除去脂質(zhì)體外水相的硫酸銨。由于離子對雙分子層滲透系數(shù)的不同,氨分子滲透系數(shù)(0.13 cm/s)較高,能很快擴散到外水相中;H
+的滲透系數(shù)遠小于氨分子,因此會使脂質(zhì)體內(nèi)水相呈酸性,形成pH梯度,梯度大小由[NH
4+]外水相/[NH
4+]內(nèi)水相比較決定,這樣使藥物逆硫酸銨梯度載入脂質(zhì)體。藥物與SO
42-形成的硫酸鹽,對雙分子層有很低滲透系數(shù),因而使藥物具有很高的包封率。
劉陶世等采用硫酸銨梯度法制備馬錢子堿脂質(zhì)體 ,0.1 mol/L硫酸銨水溶液的用量為大豆卵磷脂的66.7倍,制得的馬錢子堿脂質(zhì)體包封率在90%以上。米托恩醌以注入法或反相蒸 發(fā)法制備的脂質(zhì)體,包封率較低,但是其為弱堿性蒽醌類藥物,易與硫酸根離子形成溶解性更小的硫酸鹽,黃園用硫酸銨梯度法制備米托蒽醌脂質(zhì)體的平均粒徑均在60 nm左右,包封率為93.65%。Pan 等用不同的主動載藥法制備了5種多銨硼酸鹽脂質(zhì)體,得到較高的包封率僅為6%和15%。研究表明,用硫酸銨梯度法制備的脂質(zhì)體包封率要高于枸櫞酸鹽pH梯度法制得的脂質(zhì)體。Wong等用此法制備了環(huán)丙沙星單室脂質(zhì)體,包封率為90%。相比較于pH梯度法,硫酸銨梯度法不需要改變外水相的pH值,控制梯度也易實現(xiàn),整個過程無需緩沖液或pH滴定,內(nèi)水相只有pH梯度法更有利于脂質(zhì)體的穩(wěn)定。
2.2.3 醋酸鈣梯度法
醋酸鈣梯度法通過醋酸鈣的跨膜運動產(chǎn)生的醋酸鈣濃度梯度(內(nèi)部的濃度高于外部),使得大量質(zhì)子從脂質(zhì)體內(nèi)部轉(zhuǎn)運到外部產(chǎn)生pH梯度。醋酸的滲透參數(shù)(6.6×10
-4cm·s
-1)比Ca
2+(2.5×10
-11cm·s
-1)大7個數(shù)量級,所以很少穿越雙分子膜留在脂質(zhì)體內(nèi)部,醋酸分子則參與了質(zhì)子轉(zhuǎn)運。醋酸鈣跨膜運動產(chǎn)生的濃度梯度(內(nèi)部的濃度高于外部)導致大量質(zhì)子從脂質(zhì)體的內(nèi)部轉(zhuǎn)運到外部產(chǎn)生pH梯度,而pH的不平衡為包載和聚集弱堿藥物提供了高效驅(qū)動力。因此,在這基礎上應用醋酸鈣梯度法把弱酸藥物萘啶酸包載入預制備好的空白脂質(zhì)體中,包封率約99%,在4℃下存放10個月均穩(wěn)定未見泄露。Hwang等也用此法制備了雙氯芬酸鈉脂質(zhì)體,包封率約100%,而傳統(tǒng)的逆相蒸發(fā)法只有1%~8%。
2.3 不同的制備方法與脂質(zhì)體的結(jié)構(gòu)關系
上述制備方法的分類是按照載藥方式的不同來分的,倘若將這些制備方法進行一個總結(jié)與歸納,不難得出,這些方法一般包括以下步驟:shou先形成脂質(zhì)薄膜,其次,加入需要載入的藥物,使脂質(zhì)分散在其中,從而形成脂質(zhì)體。各種方法的區(qū)別在于脂質(zhì)分散與水相介質(zhì)的方法不同。各種方法的分散類型可以歸納為機械分散法(如薄膜分散法、手搖法、前體脂質(zhì)體法、冷凍干燥法等),溶劑分散法(如逆向蒸發(fā)法、注入法、復乳法等),物理水化法(如超聲法、薄膜振蕩分散法、薄膜勻化法、擠壓法、干燥重建脂質(zhì)體和微囊化法、凍結(jié)融解法等)及其他方法(如梯度法、表面活性法等)。
采用不同的制備方法得出來的脂質(zhì)體其結(jié)構(gòu)與大小各不相同,一般來說,采用機械分散法得到的脂質(zhì)體大多是多層脂質(zhì)體,采用逆向蒸發(fā)法得到的是大單層脂質(zhì)體,乙醇注入法中小單層脂質(zhì)體比例較高,而乙醚注入法中大單層脂質(zhì)體較多,復乳法得到的脂質(zhì)體往往是多囊脂質(zhì)體。
3.脂質(zhì)體制備方法的選擇
3.1脂質(zhì)體制備方法的選擇原則
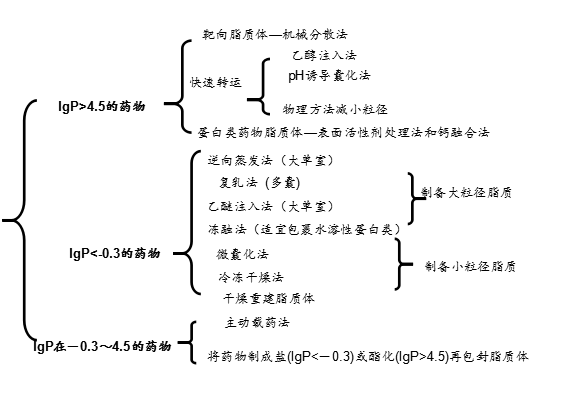
選用何種脂質(zhì)體制備方法取決于所要包裹的藥物的性質(zhì),其中**主要的性質(zhì)就是藥物的油水分配系數(shù)。
油水分配系數(shù)是指平衡狀態(tài)時,藥物在油相和水相的分配之比。一般使用藥物在辛醇—水兩相的分配系數(shù)P來表示。根據(jù)P值的大小將藥物分成三類:
LgP>4.5 脂溶性藥物
LgP<-0.3 水溶性藥物
-0.3<LgP<4.5 兩性藥物
對于不同類藥物脂質(zhì)體的制備方法選擇原則如下圖:
 3.2脂質(zhì)體生產(chǎn)制備中的實際選擇
3.2脂質(zhì)體生產(chǎn)制備中的實際選擇
許多脂質(zhì)體制備技術是以實驗室規(guī)模進行的,但這些小規(guī)模的制備技術不能直接用于大規(guī)模制備生產(chǎn)中,因為生產(chǎn)規(guī)模的變化會影響其分散性,改變制備分散體系的特性應保持在可接受的一定范圍限度內(nèi),即包封藥物的脂質(zhì)體在體內(nèi)處于無顯著變化為準則。其次,在脂質(zhì)體大規(guī)模生產(chǎn)制備過程中還得考慮實際的無菌、無熱源,粒徑的控制、穩(wěn)定性以及工藝便于放大等等實際問題。
從查閱的G內(nèi)外脂質(zhì)體制備文獻上來看,目前對于大規(guī)模生產(chǎn)脂質(zhì)體方法上大多是根據(jù)設施設備條件結(jié)合兩三中脂質(zhì)體制備方法來實現(xiàn)脂質(zhì)體的生產(chǎn)制備,如SOD的生產(chǎn)工藝就是結(jié)合了薄膜法和超聲法,阿霉素納米脂質(zhì)體的制備采用了薄膜分散法和擠壓法相結(jié)合。#p#分頁標題#e#
除了運用常規(guī)脂質(zhì)體制備方法相結(jié)合外,在脂質(zhì)體制備生產(chǎn)中還引入了其他前沿的生物學及化學上的技術。如Aphios 脂質(zhì)體公司采用超臨界流體技術制備納米級單分散的脂質(zhì)體。該技術和常規(guī)的醇注入技術有類似之處,所不同的是溶解磷脂和膽固醇時用的是超臨界流體。采用該技術,Aphios 已經(jīng)成功的將紫杉醇(paclitaxel), 喜樹堿(camptothecin)等難溶性藥物制成了脂質(zhì)體制劑。BernaBiotech公司運用Virosomes 技術已經(jīng)開發(fā)了2 個產(chǎn)品,一個是流感疫苗(Inflexal. V),一個是甲肝疫苗(Epaxal.)。Virosomes 與傳統(tǒng)脂質(zhì)體的區(qū)別主要在于,Virosomes 的磷脂雙分子層上嵌入了病毒的膜蛋白。這些蛋白可以保證Virosomes 和免疫系統(tǒng)的細胞發(fā)生融合,進而將其所包被的特異性抗原遞呈給免疫細胞。Virosomes 不僅可以模擬天然抗原的遞呈方式,還可以同時引起體液免疫和細胞免疫,進而增強疫苗的有效性。Celsion 公司采用微波熱療技術相結(jié)合,開發(fā)阿霉素熱敏脂質(zhì)體ThermoDox.,現(xiàn)已進入1 期臨床。
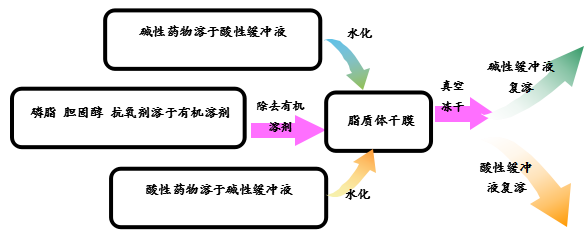
3.3脂質(zhì)體制備中包封率的影響因素及其提高辦法
影響脂質(zhì)體包封率的因素主要有脂質(zhì)體制備方法、脂質(zhì)體結(jié)構(gòu)類型、類脂膜的組成、藥物的性質(zhì)和濃度、溶劑的組成等幾大因素。
對于提高包封率除了對以上因素進行優(yōu)化之外,還可以針對所有包載的藥物的類型采取下圖所示策略來提高其包封率。
 3.3.生物研究中心現(xiàn)有脂質(zhì)體制備設備可以采用的制備方法及看法
3.3.生物研究中心現(xiàn)有脂質(zhì)體制備設備可以采用的制備方法及看法
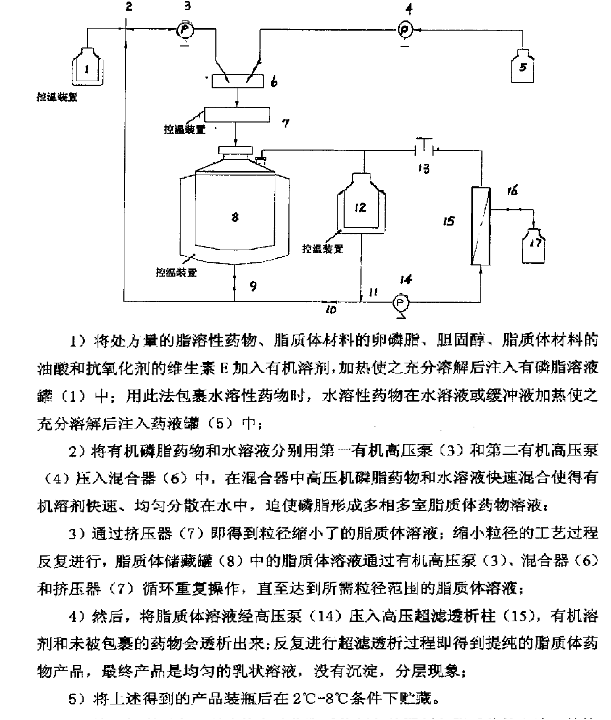
生物研究中心脂質(zhì)體制備設備可以采用的的制備方法有注入法、復乳法、擠壓法及薄膜分散法(包括逆向蒸發(fā)法),其中,以注入法和復乳法**利于現(xiàn)有工藝設施的生產(chǎn)放大。只不過,中心現(xiàn)有設備設施中,脂質(zhì)體制備工藝流程中人為操作的環(huán)節(jié)過多,不利于工藝生產(chǎn)中的再現(xiàn)性,也不利于無菌的控制。為了能更好地說明此問題,先來看下陜西力邦醫(yī)藥科技有限公司在脂質(zhì)體生產(chǎn)中所設計和采用的自動化脂質(zhì)體制備裝置,通過裝置圖及其使用流程說明,不難看出,該裝置在脂質(zhì)體制備過程中使用了分散法和擠壓法相結(jié)合。利用高壓泵提供穩(wěn)定的壓力,整個過程中避免了人員的干擾。
 參考文獻
參考文獻
鄭慶忠,劉利軍.pH梯度法制備氧化苦參堿脂質(zhì)體[J].中G醫(yī)藥工業(yè)雜志,2006,37:679.
劉陶世,蔡寶昌,趙新慧,等.硫酸銨梯度法結(jié)合微濾擠出制備馬錢子堿脂質(zhì)體的研究[J].中成藥,2005,11:1247.
黃園,段逸松.硫酸銨梯度法制備米托蒽醌脂質(zhì)體[J].中G藥學雜志,2002,12:917.
陳建明,張仰眉,高申,等.維生素A前體脂質(zhì)體的研制及其特性考察[J].第二軍醫(yī)大學學報,2003,24(2):207.
林中方,曾抗,周再高,等.鬼臼毒素二棕櫚酰磷脂酰膽堿前體脂質(zhì)體的研制及特性觀察[J].**軍醫(yī)大學學報,2004,24(7):784.
何文,夏晶.制備方法對甲氧沙林脂質(zhì)體體外性質(zhì)的影響研究[J].廣東藥學院學報,2005,6:661.
**健松,朱家壁.阿奇霉素脂質(zhì)體的制備及其包封率測定[J].中G藥科大學學報,2004,35(6):499.
丁麗燕,楊 春,李學明,等.乙醇注入法制備司帕沙星脂質(zhì)體[J].南京工業(yè)大學學報,2007,1:32.
**健松,朱家壁.乙醚注入法制備阿奇霉素脂體[J].中G藥學雜志,2005,6:876.
嚴賓,安學勤,白 晶,等.超臨界CO
2法制備頭孢唑啉鈉脂質(zhì)體[J].物理化學學報,2006,2:226.
趙妍,于彬,鄧意輝卜,等.主動載藥法制備硫酸長春新堿脂質(zhì)體及其包封率的測定[J].中G藥學雜志,2005,10:1559.
杜松,鄧英杰,張 威.主動載藥法制備鹽酸去氫駱駝蓬堿脂質(zhì)體[J].中草藥,2005,5:673.
陳濤,**九成,付經(jīng)G,等. 脂質(zhì)體藥物制劑的研究現(xiàn)狀和前景[J]. 世界**新醫(yī)學信息文摘, 2003, 2(4):721-728.
郭青龍,丁啟龍. 阿霉素前體脂質(zhì)體與阿霉素對小鼠毒性作用比較[J]. 中G藥科大學學報,1996,27(9):562-566.
**九成,慧民全,陳濤 CP 02139429.6
Gabizon AA, Liposomal drug carrier systems in cancer chemotherapy: Current status and future prospects[J]. J Drug Target,2002,10:535-538.
Frezard F, Santaella C, Montiscin MJ, et al. Fluorinated phosphatidylcholinebased liposomes: H+/Na+ permeability,active doxorubicin encapsilation and stability, in human serun[J]. Biochim Biophys Acta, 1994, 1194: 61-68.
Wang RT, Chen T, Wang Z, et al. AcidSensitive polymer liposomes prepared by poly(2ethylacrylic acid) alkylamide derivatives[J].Acta Pharmacol Sin, 2007, 42(12): 2-7.
Kim S,Martin G M.Preparation of cell-size unilamellar liposomes with high captured volume and defined size distribution [J].Biochim Biophys Acta,1983,728:339.
Tomoko Nii,Akira Takamura,Kiminori Mohri,et al.Fcators affecting physicochemical propertise of liposomes prepared with hydrogenated purifide egg yolk lecithins by the microencapsulation vesicles method[J].colloida and Surfaces B:Biointerfaces,2002:323.
Jia L,Garza M,Wong H,etal.Pharmacokonetie comparison of intravenous carbendazim and remote loaded carbendazim lipesomes in nude mice[J].J Pharm Biomed Anal,2002,28(1):65.
Chou TH,Chen SC,Chu IM.Effect of composition on the stability of liposomal irinotecan prepared by a pH gradient method [J].J Biosci Bioeng,2003,95(4):405.#p#分頁標題#e#
Mayer LD,Tai LCL,Bally MB,teal.Characterization of liposomal system containing doxorubicin entrappde in response to pH gradients [J].Biochim Biophys Acta,1990,1025(2):143.
Quan z,Sugawara M,Umezawa Y.Lasalocid .Afacilitated dopamine uphill transport and concentration into liposomes driven by pH gradient generated by bacteriorhodopsin under illumination[J].Biosens Bioelectron,1998,13(11):1157.
Pan XQ,Wang H,Shukla S,et al.Boron-containing folate receptor targeted liposomes as potential delivery agents for neutron capture therapy[J].Bioconjugate Chem,2002,13:435.
Wong JP,Yang H,Blasetti KL,et al.Liposome delivery of ciprofloxacin against intracellular Francisellatularensis infectin[J].J Controlled,2003,92(3):265.
Clerc S, Bareubolz Y.Loading of amphipathic weak acids into liposomes in response to transmembrane calcium acetate gradients [J].Biochim Biophys Acta,1995,1240:257.
Hwang SH,Maitani Y.Remote loading of diclofenac, insulin and fluorescein isothiocyanate labeled insulin into liposomes by pH and acetate gradient methods [J]Int. J. Pharm, 1999, 179:85.
陳階
2013年2月26日定稿




